Fisiología Respiratoria
Cuando los seres vivos respiran realizan un
intercambio gaseoso con el medio en el
cual se encuentran. Ingresan oxígeno para realizar su respiración
celular y expulsan al mismo medio dioxido de carbono como producto de desecho
de la respiración celular.
El como ingresan gases a los sitemas
respiratorios de los diferentes seres
vivos y el como expulsan gases de
desecho va a ser el resultado de las
propiedades de los gases, por lo tanto
para una optima comprensión de la respiración de los sers vivos debemos
comprender las leyes de los gases.
LEYES DE LOS GASES
Recordemos cuales son los estados de la materia:
Sólido:
la fuerza de cohesión de
las moléculas hace que estas estén muy próximas unas de otros con escaso margen
de movimiento entre ellas.
Líquido:
La fuerza de cohesión
molecular es menor lo cual permite mayor libertad de movimiento entre ellas.
Gaseoso:
La fuerza de
cohesión de las moléculas es muy pequeña, prácticamente nula, lo cual
permite que estas se muevan libremente y en todas direcciones. Esta libertad de movimiento es la base de los diferentes procesos de respiración en los seres vivos.
Plasma:
EL el plasma es un estado de la materia en el que prácticamente todos los átomos están ionizados y con la presencia de una cierta cantidad de electrones libres, no ligados a ningún átomo o molécula. Es un fluido, formado por electrones, e iones positivos.
https://youtu.be/0QqHe2U1g7k

LA TEORÍA CINETICO MOLECULAR
El físico Daniel Bernoulli (1700-1782) postuló en 1738 que los gases estaban compuestos por partículas que se mueven en todas las direcciones y que el impacto de las mismas sobre las paredes del recipiente que la contienen es el que genera la presión que manifiestan. La energía que poseen los base debido al movimiento se denomina energía cinética.
La teoría cinetico-molécular que poseen los gases plantean los siguientes enunciados:
1- Los gases están formados por partículas que se mueven continuamente al azar con trayectoria de linea recta. Este estado de movimiento constante y continuó se denomina agitación térmica.
2- El volumen de las moléculas del gas es mínimo en comparación con el volumen total en el que esta contenido el gas.
3- Cuando aumenta la temperatura de un gas incrementa la agitación térmica de sus partículas y el espacio ocupado es mayor que el que ocupan a menores temperaturas , por lo tanto el volumen aumenta a mayor temperatura.
4- Cuando se reduce el volumen del recipiente en el que está contenido el gas, las colisiones contra las paredes del recipiente son más frecuentes y aumenta la presión que esta ejerce.
5- Las fuerzas de atracción entre las partículas de un gas son muy débiles.
6- Todas estas colisiones moleculares son perfectamente elásticas; es decir, las moléculas coleccionan y rebotan con la misma rapidez, por lo tanto no hay pérdida de energía cinética en todo el sistema.
7- La energía cinética promedio de las partículas de un gas es proporcional a la temperatura absoluta. Teóricamente a cero Kelvin no hay movimiento molecular y la energía cinética es cero.
El estado gaseoso es
un estado disperso de la materia, es decir , que las moléculas del gas están
separadas unas de otras por distancias mucho mayores del tamaño del diámetro
real de las moléculas. Resuelta entonces, que el volumen ocupado por el gas (V)
depende de la presión (P), la temperatura (T) y de la cantidad o
numero de moles ( n).
Ley de los gases ideales
Hablamos de los gases ideales de manera hipotética ya que difícilmente ello se ve en la Realidad. Las moléculas que componen a un gas ideal no se suelen atraer o repeler entre si, y su volumen es despreciable en comparación con el volumen del recipiente que lo contiene. Aunque en nuestra naturaleza no exista el caso de un gas ideal, las diferencias entre el comportamiento de un gas real en márgenes de temperatura y presión no alteran sustancialmente los cálculos, por lo que podemos hacer uso de la ecuación con toda la seguridad, para resolver diversos ejercicios de gases.
En nuestro estudio de las leyes de los gases, hemos visto la relación de la temperatura, presión y volumen. Tal como se muestra en la siguiente fórmula de la ley general de los gases:
P1V1/T1 = P2V2/T2
Podríamos decir que la igualdad es igual a una constante en general, que la vamos a llamar “K”.
PV/T = K
Si movemos a “T” para que pase a multiplicar a “K”, la ecuación quedaría:
PV = KT
El valor de “K” lo vamos a relacionar en función del número de moles (n) de cualquier gas, esto tiene por ecuación la siguiente fórmula:
K= nR
Si sustituimos la K = nR en la ecuación que tenemos de Presión por Volumen, vamos a dar con la siguiente fórmula:
PV = nR(K)
Dónde:
P = Presión absoluta a la que se encuentra el gas
V = Volumen ocupado por el gas
n = Número de moles del gas que se calcula dividiendo su masa entre su peso molecular
n= m/PM
R = Es la constante universal de los gases y su valor depende de las unidades usadas para su cálculo.
La ecuación de la ley de los gases ideales es una de las ecuaciones más utilizadas en fisicoquímica, pues nos permite realizar varios cálculos conociendo el valor de R, ya que establece una relación entre la presión, el volumen, la temperatura y número de moles de un gas
LAS LEYES DE LOS GASES
1. Se adaptan a la forma y el volumen del
recipiente que los contiene. Un gas, al cambiar de recipiente, se expande o se
comprime, de manera que ocupa todo el volumen y toma la forma de su nuevo
recipiente.
2. Se dejan comprimir fácilmente. Al existir
espacios intermoleculares, las moléculas se pueden acercar unas a otras
reduciendo su volumen, cuando aplicamos una presión.
3. Se difunden fácilmente. Al no existir fuerza
de atracción intermolecular entre sus partículas, los gases se esparcen en
forma espontánea.
4. Se dilatan, la energía cinética promedio de
sus moléculas es directamente proporcional a la temperatura aplicada.
Variables que
afectan el comportamiento de los gases
1. PRESIÓN
Es la fuerza ejercida
por unidad de área. En los gases esta fuerza actúa en forma uniforme sobre
todas las partes del recipiente.
La presión atmosférica
es la fuerza ejercida por la atmósfera sobre los cuerpos que están en la
superficie terrestre. Se origina del peso del aire que la forma. Mientras más
alto se halle un cuerpo menos aire hay por encima de él, por consiguiente la
presión sobre él será menor.
2. TEMPERATURA
Es una medida de la
intensidad del calor, y el calor a su vez es una forma de energía que podemos
medir en unidades de calorías. Cuando un cuerpo caliente se coloca en contacto
con uno frío, el calor fluye del cuerpo caliente al cuerpo frío.
La temperatura de un
gas es proporcional a la energía cinética media de las moléculas del gas. A
mayor energía cinética mayor temperatura y viceversa.
La temperatura de los
gases se expresa en grados kelvin.
3. CANTIDAD
La cantidad de un gas
se puede medir en unidades de masa, usualmente en gramos. De acuerdo con el
sistema de unidades Si, la cantidad también se expresa mediante el número de
moles de sustancia, (n) esta puede calcularse dividiendo el peso del gas por su
peso molecular.
4. VOLUMEN
Es el espacio ocupado
por un cuerpo.
5. DENSIDAD
El número de moles
es igual a m/M, donde m es la masa presente y M la masa molecular del gas, y la
densidad es m/V.
a
unas determinadas condiciones de presión y temperatura, la densidad de un gas
depende únicamente de su masa molecular, siendo ambas magnitudes directamente proporcionales. De este
modo, los gases con masas moleculares menores que la media ponderada del
aire serán menos densos que éste,
cuando
un gas es más denso que el aire, este se acumula en la parte inferior y que,
por el contrario, si es menos denso se acumula en la parte superior.
PRESIÓN ATMOSFERICA:
Presión
En Física, presión (P) se define como la relación que existe entre una fuerza (F) y la superficie (S) sobre la que se aplica, y se calcula con la fórmula:
P = F/S
Lo cual significa que la Presión (P) es igual a la Fuerza (F) aplicada dividido por la superficie (S) sobre la cual se aplica.
La Presión se define como la fuerza por unidad de superficie que ejerce un líquido o un gas perpendicularmente a dicha superficie.
La presión atmosférica es la fuerza que ejerce el aire atmosférico sobre la superficie terrestre. Aunque el aire no es un material muy pesado, , la enorme cantidad de aire que existe sobre un punto de la tierra hace que su peso total sea lo suficientemente grande como para que la presión que ejerce sobre este punto tenga una gran magnitud.
En el siguiente link encontrarán unos experimentos sencillos que evidencian la existencia de la presión atmosférica.
https://www.youtube.com/watch?feature=player_detailpage&v=d7xvPQMrMdo
https://www.youtube.com/watch?v=XLQ6s4szs3c
Como medir la presión atmosférica:
La presión se mide mediante un barómetro y su valor, expresado en torrs, está relacionado con la altura a la que la presión atmosférica mantiene una columna de mercurio; 1 torr equivale a 1 mm de mercurio. La presión atmosférica normal a nivel del mar es de 760 torrs, o sea, 760 mm de mercurio. En torno a los 5,6 Km. es de 380 torrs; la mitad de todo el aire presente en la atmósfera se encuentra por debajo de este nivel. La presión disminuye más o menos a la mitad por cada 5,6 Km. de ascensión. A una altitud de 80 Km. la presión es de 0,007 torr.
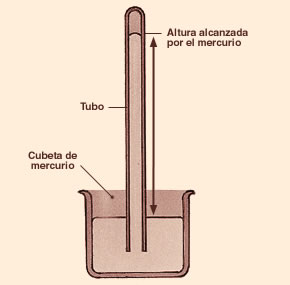
BARÓMETRO DE MERCURIO.
Un barómetro de mercurio de Torricelli se puede construir fácilmente. Se llena de mercurio un tubo delgado de vidrio de unos 80 cm de longitud y cerrado por un extremo; se tapa el otro extremo y se sumerge en una cubeta que contenga también mercurio; si entonces se destapa se verá que el mercurio del tubo desciende unos centímetros, dejando en la parte superior un espacio vacío (cámara barométrica o vacío de Torricelli).
Veamos la presión atmosférica relacionada con la altitud de una de nuestras principales ciudades:
Ciudad Altitud (Mts sobre el nivel de mar) Presión atmosférica (mm hg)
Cartagena 0 760
Cali 995 670
Pereira 1411 637
Bogotá 2640 560
LEYES DE LOS GASES Y SU RELACIÓN CON LA RESPIRACIÓN:
Ley de BOYLE:
Esta ley nos permite relacionar la presión y el volumen
de un gas cuando la temperatura es constante.
La ley de Boyle (conocida también como de Boyle y Mariotte) establece que la presión
de un gas en un recipiente cerrado es inversamente proporcional al volumen
del recipiente, cuando la temperatura es constante.
Lo cual significa que:
El volumen de un gas es inversamente proporcional a la presión que se le
aplica:
En otras palabras:
Si la presión aumenta, el volumen disminuye.
Si la presión disminuye, el volumen aumenta.
Esto nos conduce a que, si la cantidad de gas y la temperatura permanecen
constantes, el producto de la presión por el volumen siempre tiene el mismo
valor.
Matemáticamente esto es: P.V = K
lo cual significa que el producto de la presión por el volumen es
constante.
Para aclarar el concepto:
Tenemos un cierto volumen de gas (V
1) que se encuentra a una
presión P
1. Si variamos la presión a P
2, el volumen de
gas variará hasta un nuevo valor V
2, y se cumplirá:
P1.V1= P2.V2
que es otra manera de expresar la ley de Boyle
Apliquemos la fórmula en un ejemplo práctico:
Tenemos 4 L de un gas que están a 600 mmHg de presión. ¿Cuál será su volumen
si aumentamos la presión hasta 800 mmHg? La temperatura es constante, no varía.
Solución:
Como los datos de presión están ambos en milímetros de mercurio (mmHg) no es
necesario hacer la conversión a atmósferas (atm). Si solo uno de ellos
estuviera en mmHg y el otro en atm, habría que dejar los dos en atm.
Aclarado esto, sustituimos los valores en la ecuación
P1V1
= P2V2.
600 mmhg X 4 L = 800 mmhg X V2 600 mmhg X 4 L/800 mm hg = V2
V2= 3L
Si aumentamos la presión hasta 800 mmHg el volumen disminuye hasta llegar a
los 3 L.
LEY DE CHARLES
Jacques A Charles (1746-1823) estableció que si se mantiene la presión constante, el volumen de un gas incrementa a medida que aumenta la temperatura
V/T = K cuando p y n se mantienen constantes
V= volumen
T= temperatura
P= presión
n= cantidad o número de moles
Cuando un gas experimenta transformación a presión constante, el coeficiente entre el volumen que ocupa y su temperatura absoluta permanecen contantes en ambas situaciones
V1/T1 = V2/T2
Dónde:
T1 = Temperatura inicial
T2 = Temperatura final
V1 = Volumen inicial
V2 = Volumen final
¡Muy importante! La temperatura la vamos a medir en grados Kelvin (ºK) y el volumen en cm3 ¡
Se tiene un gas a una presión constante de 560 mm de Hg, el gas ocupa un volumen de 23 cm³ a una temperatura que está en 69°C . ¿Qué volumen ocupará el gas a una temperatura de 13°C?
y aquí algo totalmente importante, Los problemas de Charles se trabajan en escala absoluta, es decir la temperatura debe estar en grados Kelvin, para ello no es gran ciencia, solo debemos sumar 273 a las temperaturas que tenemos en grados Celcius también conocido como centígrados, quedando de la siguiente forma,
T1 = 69º + 273 = 343ºK
T2 = 13 + 272 = 286ºK
Ahora solo nos queda reemplazar en la fórmula de la ley de charles , quedando lo siguiente:
V2= V1XT2/T1
V2 = (23
cm³)(286ºK)/342ºK
V2= 19.23
cm³

Ley de Gay-Lussac:
https://youtu.be/OJ9_mgkwZAk
Joseph louis Gay-Lussac estudió las variaciones de presión de un gas cuando se cambia la temperatura gases cuando pero se mantiene constante el volumen del recipiente que lo contiene. En todo proceso isocórico ( igual volumen), la presión ejercida por un gas aumenta en forma proporcional a la temperatura absoluta. Matemáticamente se expresa:
P/T = K cuando V y n son constantes
En determinadas condiciones iniciales y finales de presión y volumen, cuando el volumen un gas no cambia, en coeficiente P/T es siempre el mismo entonces
P1/T1 = P2/T2 entonces P1 X T2 = P2 X T1
Ejemplo:
Tenemos un gas a 20ºC y 100 mmHg. A que temperatura se encontrará el gas si la presión ha aumentado a 400 mmHg.
T1 = 20ºC convertimos a Kelvin 273 + 20 293 K
P1= 100 mmHg
P2 = 400 mmHg
T2= ?
T2 = P2 X T1/P1 T2 = 400 mmHg X 293K/100 mmHg T2 = 4 X 293K T2 = 1.172 K
P1 X T2 = P2 X T1
Ley de las Presiones Parciales de Dalton:
La ley de las presiones parciales (conocida también como ley de Dalton) fue formulada en el año 1801 por el físico, químico y matemático británico John Dalton. Establece que la presión de una mezcla de gases, que no reaccionan químicamente, es igual a la suma de las presiones parciales que ejercería cada uno de ellos si sólo uno ocupase todo el volumen de la mezcla, sin variar la temperatura
La ley de Dalton es muy útil cuando deseamos determinar la relación que
existe entre las presiones parciales y la presión total de una mezcla.
Se puede hacer una definición de la teoría mediante la aplicación de
matemáticas, la presión de una mezcla de gases puede expresarse como una
suma de presiones mediante:
P total = P1 + P2 + ............... + Pn
- Está relación se conoce como Ley de las Presiones Parciales de Dalton e indica que la presión total de una mezcla de gases es igual a la suma de las presiones parciales de los componentes de la mezcla.
-
Composición del aire:
El aire está compuesto de la siguiente manera:
Oxígeno: (O2) 21%
Nitrógeno: (N2) 78.7%
Dióxido de carbono:( CO2) 0,03%
A nivel del mar 760 mmhg el Oxígeno ejerce la siguiente presión parcial
760 mmhg x 21% = 159,6 mmhg.
En Bogotá:
560 mmhg X 21% = 117,6 mmhg
LEY DE HENRY
Un gas tiene sus moléculas en constante movimiento y, de esa manera, esas moléculas se chocan con los obstáculos que encuentran en el camino. Cuando el obstáculo que el gas encuentra es la superficie de un líquido, de vez en cuando, moléculas con un poco más de velocidad logran penetrar en el líquido, quedando disueltas.
Como vivimos en un planeta envuelto por una atmósfera gaseosa, los líquidos, salvo en situaciones de almacenaje muy especiales, están siempre en contacto con gas, haciéndoles siempre disolver parte de él. Así el contacto con la atmósfera es que garantiza que una parte del oxígeno del aire termine dentro de los océanos y dé soporte a la respiración de toda la fauna marina
SOLUCIONES
Se llama solución a mezclas homogéneas de dos o más componentes, o dicho de otro modo una solución es una mezcla íntima entre dos o más sustancias.
Si se pone en contacto un Solvente (líquido) y un soluto (gas), este último tenderá a disolverse en el líquido hasta alcanzar cierto equilibrio, una vez obtenido este permanecerá constante en el tiempo, mientras la Presión [P] y la Temperatura [T] se mantengan constantes.
Si se incrementa la Presión [P] y, se mantiene la Temperatura [T] constante, mayor cantidad de moléculas de gas se disolverán en el líquido, hasta llegar a un nuevo equilibrio.
fue formulada en 1803 por William Henry y enuncia que, a una temperatura constante, la cantidad de gas disuelto en un líquido es directamente proporcional a la presión parcial que ejerce ese gas sobre el líquido.
Cuando
a una temperatura constante, un gas entra en contacto con un líquido,
se disuelve en él hasta el momento en que la presión exterior e interior
alcancen el punto de equilibrio.
Esta ley ayuda a entender la volatilidad de las sustancias, es
decir la facilidad con que una sustancia disuelta en agua se transforma
en gas y pasa a la atmósfera.
Cada sustancia tiene una volatilidad diferente, la cual puede ser calculada
a través de su constante de la Ley de Henry. Esta constante, también
conocida como coeficiente e partición aire/agua, es un indicador
de la solubilidad de la fracción gaseosa de la sustancia en un líquido,
específicamente en agua.
La cantidad de soluto (gas) que se disuelve en un volumen determinado de un solvente (líquido) a temperatura constante, es directamente proporcional a la Presión Parcial [pG] que ejerce el gas".
Enunciada de otro modo:
S = pG x K
La solubilidad de un gas (S) es igual a la presión parcial de gas por una contante la cual es característica de cada gas y cada solvente.
Según sea la cantidad o volumen de soluto disuelto se reconocen tres estados de saturación:
Estado no saturado: es aquel donde el solvente (líquido), puede continuar disolviendo soluto (gas).
Estado saturado: o de equilibrio, a aquel en que la cantidad de soluto (gas).disuelto es proporcional a su presión parcial y el volumen disuelto permanecerá constante, mientras la presión y/o temperatura no varíen.
Estado sobresaturado: es aquel donde el solvente (líquido) contiene más soluto (gas) que el que puede disolver.
El ejemplo de una solución sobresaturada lo constituyen la bebidas gaseosa, la cuales contienen tal cantidad de gas debido a que bajo la tapa se mantiene una presión superior a la atmosférica.
Las presiones parciales, la ley de Henrry y el intercambio de gases alveolo-capilar
La principal función del aparato respiratorio es inhalar oxígeno y eliminar dióxido de carbono. El oxígeno inhalado penetra en los pulmones y alcanza los alvéolos. Las capas de células que revisten los alvéolos y los capilares circundantes se disponen ocupando el espesor de una sola célula y están en contacto estrecho unas con otras. Esta barrera entre el aire y la sangre tiene un grosor aproximado de una micra (1/10 000 cm). El oxígeno atraviesa rápidamente esta barrera aire–sangre y llega hasta la sangre que circula por los capilares. Igualmente, el dióxido de carbono pasa de la sangre al interior de los alvéolos, desde donde es exhalado al exterior.
El intercambio de gases es directamente proporcional a los gradientes de presiones entre el aire alveolar y los capilares venosos pulmonares. La presión alveolas de oxígeno se determina con la siguiente ecuación:
PAO2 = 0.21(presión barometrica en mmHg- 47 mm Hg) - PACO2
La presión parcial de oxígeno en los alveolos disminuye por la presión ejercida por el vapor de agua, la cual es de 47 mmHg.
La presión alveolar de dioxido de carbono (PACO2) normalmente es igual a 35 mmHg.
De acuerdo a la presión atmosferica, podemos calcular el valor aproximado de la Presión alveolar de oxígeno. Por ejemplo, presión atmosférica de 600 mmHg
0,21 (600mmHg- 47 mmHg) - 35
0.21 (553) - 35 = 81,13
La sangre baja en oxígeno de los capilares arteriales pulmonares llega a los alveolos con las siguientes presiones:
PO2 = 40 mm Hg
PCO2 = 46 mmH
Y se satura con oxigeno hasta una presión cercana a 100 mmHg (PO2= 100 mmHg). El CO2 por gradientes pasa de los capilares pulmonares a los avelos y la PCO2 baja a 40 mmHG
Veamos algunas situaciones de interés que ahora podemos comprender a partir de los anteriores conceptos físicos.
PRESURIZACIÓN
Se trata de la acción que se desarrolla para resguardar, en un cierto ámbito, las condiciones normales de presión atmosférica, aún cuando en el exterior dicha presión sea muy diferente. Para que una aeronave pueda volar, es imprescindible que su cabina esté presurizada ya que, de otro modo, el oxígeno disponible en el interior del avión sería insuficiente y sus ocupantes se enfrentarían a diversos trastornos, como dolores de cabeza o mareos. En los casos más extremos, los problemas de presurización pueden causar la muerte.
Para presurizar la cabina, los aviones cuentan con un sistema de control ambiental. De esta manera, una parte del aire que ingresa al motor de la aeronave es desviado hacia un compresor. Esta máquina calienta dicho aire y lo envía a la cabina de los pasajeros, haciendo que la cantidad de oxígeno por unidad de volumen resulte parecida a la que se halla en las zonas de baja altitud, aún cuando el avión esté volando a gran altura.
Es importante tener en cuenta que los aviones sólo soportan una cierta diferencia de presión entre su interior y el exterior. Cuando dicha diferencia es más grande de lo que pueden soportar, se produce una explosión.
Por lo tanto, para que un avión pueda volar sin que los tripulantes y los pasajeros sufran problemas, no alcanza con presurizar el aire. También se debe controlar que exista un cierto equilibrio entre la presión interior y la presión exterior, algo que se realiza de manera automática (con un sistema que permite la salida de algo de aire cuando la presión interior sube demasiado) pero que también puede controlarse de forma manual.
uso de la técnica de presurización en aviones data de la década de 1930, dado que el Boeing B-307 Stratoliner ya contaba con una cabina presurizada. Además, hacía posible que el ingeniero de vuelo fuera parte de la tripulación para controlar este subsistema, así como la presión de combustible, los niveles de potencia y la ruta, lo que permitía al piloto dedicar toda su atención al control de la aeronave.
¿COMO INTERVIENEN ESTAS PROPIEDADES EN LA RESPIRACIÓN DE LOS SERES VIVOS?
Si han comprendido hasta lo visto hasta ahora, les va a ser sencillo al estudiar las próximas paginas comprender tópicos como:
¿Como respiran los diferentes seres vivos?
¿Por que es tan diferente respirar a nivel del mar y en un páramo?
¿De donde obtienen el oxígeno los seres acuáticos?
¿ Por que si contaminamos el agua estamos poniendo fin a los seres vivos que habitan en ella.?
¿Comprenderán facilmente como pueden respirar seres en medio acuático o aéreo?
¿Cuales son los peligros del apasionante mundo del buceo ?
Espero que estos apasionantes temas hallan sido de su interés. Pueden hacer comentarios, aportes, plantear inquietudes.
Hasta pronto.
















Muy interesante y completo WOW súper útil
ResponderEliminar